概述
CAR-T细胞治疗(Chimeric Antigen Receptor T-Cell Therapy,嵌合抗原受体T细胞治疗)是一项国际前沿的细胞免疫疗法。该技术通过基因工程改造患者自身或供者的淋巴细胞,使其能够精准识别并定向清除肿瘤细胞。
这一疗法的出现,不仅为血液系统恶性肿瘤患者带来了新的治愈希望,也正在自身免疫性疾病与实体瘤的治疗探索中展现出广阔潜力,为更多缺乏有效治疗手段的患者打开了新的生命通道。
CAR-T 细胞疗法常见应用
为什么选择高博?
高博在中国率先系统化开展CAR-T细胞治疗,持续推进该技术的规范化建设与临床创新。目前已累计实施数千例CAR-T治疗,在长期的临床实践中积累了深厚经验,并在多种疾病类型中取得了经临床验证的疗效与良好的安全性。
全面的治疗靶点布局
高博已建立成熟的CAR-T技术体系,靶点覆盖范围广泛,实现了从血液肿瘤到实体瘤的多领域精准治疗探索。
- 血液肿瘤的治疗靶点:
- 单靶点CAR-T:CD19、CD20、CD22、CD7、CD5、BCMA、GPRC5D、CLL1等
- 双靶点CAR-T:CD19&CD22-CAR-T、CD19&CD20-CAR-T、CD22&CD20-CAR-T、BCMA&GPRC5D-CART、CD19&BCMA-CART
- 实体瘤的治疗靶点:Claudin18.2 CAR-T等
创新的联合治疗策略
高博在长期的临床探索中,积极推动CAR-T与多种传统及新型治疗方式的整合应用,包括化疗、靶向药物治疗、造血干细胞移植等。多手段联合策略的实施显著提高了复发/难治性患者的总体缓解率和长期生存率。
全程化的治疗和照护管理
高博建立了覆盖CAR-T治疗评估、实施、监测与照护的一体化管理体系,从患者入组、细胞制备到治疗执行与康复随访各阶段,均提供系统化、个体化支持。通过标准化流程与多学科协作,确保治疗的安全性、有效性与长期随访质量。
多学科协作
高博实行以患者为中心的多学科协作(MDT)模式,由血液科与整合诊断、感染影像学科、呼吸病学科等学科协作,在诊断、治疗与并发症管理方面实现高效协同,形成了以精准、系统、全面为核心特色的交叉学科诊疗体系。
我们的卓越成果
CAR-T 细胞治疗复发 / 难治白血病的卓越疗效
- CD19 CAR-T细胞疗法治疗复发/难治性急性B淋巴细胞白血病(R/R B-ALL):完全缓解(CR)率超过90%
- 序贯CD19和CD22 CAR-T细胞治疗移植后复发的急性B淋巴细胞白血病(B-ALL):12个月和18个月的总体生存率(OS)分别为88.5%和67.5%
- CD22 CAR-T治疗既往经CD19 CAR-T治疗后失败的患者:完全缓解率达71%,微小残留病(MRD)转阴率接近100%,显著优于同期国际研究结果。
- 序贯CD19和CD22 CAR-T细胞疗法治疗儿童R/R B-ALL(Ⅱ期研究):18个月无事件生存率(EFS)79%,无病生存率(DFS)80%;总体生存率(OS)96%。
- CD19 CAR-T治疗CD19抗原表达的复发/难治性非B细胞急性白血病(AML,T-ALL),完全缓解率达到62.5%。
- 供者来源CD7 CAR-T治疗难治复发急性T淋巴细胞白血病(R/R T-ALL):完全缓解(CR)率90%。
- 供者来源CD7 CAR-T治疗T-ALL长期随访:中位随访时间27.0个月,客观缓解率(ORR)为95%,完全缓解率(CR)为85%。
- 供者来源CD5 CAR-T治疗R/R T-ALL:所有患者(100%)在CAR-T输注第30天均达到了完全缓解(CR)或完全缓解伴血液学不完全恢复(CRi)。
- 在R/R T-ALL患者中开展无T细胞分选制备自体CD7 CAR-T治疗:在CAR-T输注的第30天,96%的患者见效,且85%的患者达到完全缓解(CR)或完全缓解伴血液学不完全恢复(CRi)。
CAR-T 细胞治疗复发 / 难治淋巴瘤和多发性骨髓瘤的卓越疗效
- 高博医疗团队在全球首次报道采用CD19/CD20/CD22三靶点CAR-T治疗儿童难治复发伯基特淋巴瘤(R/R BL):实现了高达100%的应答率和86.9%的18个月完全缓解(CR)率。
- 自体造血干细胞移植联合CAR-T细胞疗法治疗复发/难治性中枢神经系统B细胞淋巴瘤:客观缓解率(ORR)为74%,一年的ORR为85.1%,无进展生存率(PFS)为44.5%。此外,免疫效应细胞相关神经毒性综合症(ICANS)可控。
- 供者CAR-T作为预处理方案的异基因造血干细胞移植治疗难治/复发性B细胞淋巴瘤:中位随访期为249天(范围179-263天)时,完全缓解率(CR)达75%。6个月的总生存率(OS)与无进展生存率(PFS)分别为75%和62.5%。
疗效数据来源于公开发表研究成果及本中心长期随访结果,仅供医学信息参考。具体疗效因个体差异、疾病类型及综合治疗策略而异,请遵循专业医生的评估与建议,制定适合您的个体化诊疗方案
相关阅读
Nature Medicine发表由高博医疗集团北京高博医院、实验血液学国家重点实验室、国家血液系统疾病临床医学研究中心、中国医学科学院血液病医院(中国医学科学院血液学研究所)等机构共同完成的《Allogeneic CD5-specific CAR-T therapy for relapsed/refractory T-ALL: a phase 1 trial》(异体CD5 CAR-T治疗复发/难治性T淋巴细胞白血病:I期临床试验),该研究由潘静、冯晓明为共同通讯作者。
l 完整报道供者CD5 CAR-T治疗T-ALL的Ⅰ期临床试验数据
因为缺乏有效的挽救疗法,复发/难治性急性T淋巴细胞(R/R T-ALL)患者预后不佳。近年来,CD7 CAR-T的嵌合抗原受体 (CAR)-T细胞疗法在 r/r T-ALL 患者中显示出疗效,但CD7丢失后的复发很常见。
该项研究评估了CD5 CAR-T治疗R/R T-ALL的安全性、疗效和药代动力学。研究纳入了19例R/R T-ALL患者,其中大多数患者先前接受过 CD7 CAR-T 细胞治疗疗。CAR-T 细胞来自造血干细胞移植供者,主要研究终点是21天的剂量限制性毒性和30天内的不良事件,次要终点是30天后的应答、药代动力学和严重不良事件。
该研究发现:
- 安全性方面:该疗法显示出良好的安全性,没有观察到剂量限制性毒性,并且不良事件主要为可控的血液学毒性。
- 疗效方面:该疗法显示出良好的疗效,所有患者在第30天均达到完全缓解或伴随不完全血细胞计数恢复的完全缓解。
- 药代动力学方面:CD5 CAR-T细胞在体内持续存在并清除 CD5+T细胞,但CD5¯ T细胞有所增加,但仍低于正常水平。
- 感染风险方面:严重感染主要发生在输注后30天后未接受后续造血干细移植的患者中,与之前CD7 CAR-T治疗淋巴细胞减少、CD5 CAR-T细胞输注后的CD7 CAR细胞共存或靶向T/B/NK 细胞消耗有关。
此外,该研究还探讨了:
- CD7 CAR-T细胞与CD5 CAR-T细胞共存的影响。
- CAR-T细胞的扩增和生物标志物。
- T 细胞和B细胞减少的动力学。
- 患者体内CD5基因编辑的T细胞的特征。
该研究为提供了CD5 CAR-T细胞治疗的思路。研究表明 CD5 CAR-T细胞治疗可能是治疗R/R T-ALL 患者的一种有前途的方案,并为未来优化其治疗策略提供了方向,但需要进一步的研究,特别是如何降低严重感染的风险。
l 直面临床难点,持续深耕R/R T-ALL治疗靶点更优选择
鉴于CAR-T细胞疗法在B系肿瘤中取得的突破性进展,越来越多的研究旨在开发新的CAR-T疗法治疗T-ALL,团队也将目光聚焦在CAR-T细胞治疗T系肿瘤上,探索T系肿瘤 CAR-T的更优治疗策略。
• 供者CD7 CAR-T治疗R/R T-ALL
2021年7月,北京高博博仁医院潘静主任团队、中国医学科学院血液病医院(中国医学科学院血液学研究所)冯晓明教授团队、同济大学医学院张鸿声教授团队等机构共同完成的“Donor-Derived CD7 Chimeric Antigen Receptor T Cells for T-Cell Acute Lymphoblastic Leukemia: First-in-Human, Phase I Trial”研究在线发表于Journal of Clinical Oncology(IF=45), 该项研究不仅证实了供体来源CD7 CAR-T细胞疗法在R/R T-ALL患者中的早期疗效,更显示出研究在该领域的突破与开创价值。
2023年,有关该项研究长期安全性和疗效持久性的2年随访结果,也已出炉:“Long-term follow-up of donor-derived CD7 CAR T-cell therapy in patients with T-cell acute lymphoblastic leukemia”,并于2023年4月发表于Journal of Hematology & Oncology(IF=23.168), 治疗后24个月的无进展生存(PFS)率和总生存(OS)率分别为36.8%(95% CI,13.8%~59.8%)和42.3%(95% CI,18.8%~65.8%),中位PFS和OS分别为11.0(95% CI,6.7~12.5)个月和18.3(95% CI,12.5~20.8)个月。
• 自体CD7 CAR-T治疗R/R T-ALL
以CD7为靶点的供者来源CAR-T细胞治疗T淋巴母细胞白血病/淋巴瘤(T-ALL/LBL)的临床研究,证实了CD7 CAR-T在r/r T-ALL/LBL中具有很高的缓解率。然而,团队也观察到随之而来的移植物抗宿主病(GVHD)、感染等问题成为亟待解决的难题。基于此,团队开始逐渐优化CAR-T的治疗策略——为不同的T系肿瘤患者选择更适合他们的CAR-T。
对于很多既往未接受过很多线治疗的T-ALL患者而言,他们体内仍能够采集到足够量的正常、健康的淋巴细胞,团队开始着手去为这一类患者进行自体 CD7 CAR-T的治疗。最新研究“Autologous CD7 CAR T cells generated without T-cell pre-selection in pediatric patients with relapsed/refractory T-ALL: a phase I trial”发表于Molecular Therapy(IF:12.4),初步探索和揭示无T细胞分选的自体CD7 CAR-T细胞的制备、以及其治疗r/r T-ALL的疗效与安全性。研究结果显示疗效和安全性达预期。
• 供者CD5 CAR-T治疗R/R T-ALL
随着CD7 CAR-T治疗R/R T-ALL/和T-LBL相关的临床试验陆续推进,这些患者复发后应如何应对是值得深思的。根据既往的研究提示,CD7 CAR-T治疗后的患者往往以CD7阴性的方式复发,后续的挽救性治疗方式是大家持续关注的问题,是临床必须要去解决的难点。团队探索了T系肿瘤CAR-T治疗的第二个靶点CD5 CAR-T,并对于疗效与安全性进行了初步验证,为CD7 CAR-T治疗失败或者CD7不表达的患者提供了一种补充疗法。这项研究获得学术界的认可并发表于Nature Medicine,此前在2023年第28届欧洲血液学会(EHA)年会上,潘静主任团队这项研究的结果入选了大会口头报告。
l 多团队的通力协作,为临床研究的顺利进行提供了保障
不同于B系CAR-T治疗,T系CAR-T的研发应用面临着更大的挑战,应用给患者带来了“人为制造的免疫缺陷”,那这样的治疗是否能最终成药?是否能给患者带来获益?是团队一直思考的问题,团队也坚信这一领域的研究能够为患者带来重大价值。为此,潘静主任及合作团队开展了一系列的研究,包括靶点的探索、复发及相关机制的研究等,寻求平衡安全与疗效的T系CAR-T血液肿瘤治疗的更优解。
该项研究由北京高博医院,北京高博博仁医院,实验血液学国家重点实验室、国家血液系统疾病临床医学研究中心、中国医学科学院血液病医院(中国医学科学院血液学研究所),细胞生态海河实验室,驯鹿医疗,德克萨斯大学安德森癌证中心、福建协和医院等机构的研究者共同完成。正是团队以患者为中心,解决患者治疗需求的初心与坚守,以及患者的信任,成就了持续突破与创新。
未来,团队也将继续与各个领域的专家学者深度合作,从而更好地利用CAR-T治疗这一创新手段去帮助更多的T系肿瘤患者。


来自俄罗斯的淋巴瘤患者Maria第二次来到高博医疗集团北京高博博仁医院接受治疗。对她而言,这不仅是跨越国界的求医之路,更是一段重新夺回健康与高质量生活的关键旅程。她的主诊医生、血液肿瘤专家张亚晶主任回顾了整个治疗过程——从第一次远程会诊,到危急病情的逆转,再到如今即将出院的稳定状态,每一步都至关重要。
第一次来华:病情危重,随时可能恶化
Maria 第一次抵达北京是在今年 6 月。那时,她的病情已十分严峻。张亚晶主任仍清晰记得她在海外远程会诊时的状态:“她当时非常危险,高热甚至达到了四十多度,这种发热强度在临床上极为罕见。”更棘手的是,她的肿瘤非常“顽固”——一次治疗才刚刚起效,血象尚未恢复,肿瘤细胞便迅速反弹,而且出现了中枢神经系统受累和肝脏等多器官受损。在当时的医学判断里,她的整体情况正处于高风险的危险边缘。
Maria本人非常年轻、美丽,对生活质量也有着明确要求——“不仅要活下来,还希望能活得好。”在充分评估后,团队为她制定了多靶点CAR-T为核心的综合治疗方案。第一次治疗采用CD19+CD22双靶点 CAR-T。治疗结束后,她的病情明显改善,之前所有的高度侵袭性表现,包括中枢及肝脏受累,都逐步得到控制。
第二次来华:为实现更长期缓解而战
尽管前期治疗取得了良好的效果,但Maria的疾病本身具有很高的复发风险。在张亚晶主任团队的原计划中,建议Maria在缓解后进一步接受造血干细胞移植。然而,Maria 回国后,当地权威医生评估其身体状况可能无法承受移植强度。在这种情况下,张亚晶主任团队重新规划了治疗路径,决定实施序贯 CAR-T巩固治疗,同时更换了靶点——根据其肿瘤抗原表达情况选择了CD20 + CD79b 双靶点方案。
张亚晶主任解释说:“选择序贯治疗,并不是简单重复,而是基于她的肿瘤生物学特征、第一次治疗反应等多维度综合判断,追求更深层次的缓解。”如今,第二次治疗已顺利接近尾声,Maria将在本周出院,她的病情已保持稳定,先前那些令人担忧的侵袭性表现未再出现,整体治疗反应令人欣慰。
全生命周期管理:不仅治病,更要让患者安心走得更远
Maria对生活质量有极高要求,对医学理解力强、配合度高,这让医疗团队能够与她建立更顺畅的沟通和合作模式。为确保长期管理效果,张亚晶主任团队为她制定了全生命周期的随访计划,包括前两年进行更密集、结构化的随访,明确每月的检查检验项目,并在关键检查节点后提供线上一对一深度沟通,指导下一阶段治疗,按需及时调整方案。Maria 对此感到非常安心,也对治疗效果和医疗服务体验给予了高度评价。
从危急状态到第二次跨国求医,从精准治疗策略的制定到即将顺利出院,Maria的经历不仅体现了专业的医疗决策,更体现了“以患者为中心”的医疗理念——为生命负责,为未来负责。


2025年6月1日,由沈琳教授团队设计主导的全球首个CLDN18.2 CAR-T胃癌随机对照研究,“Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician’s choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial”的阳性结果正式发布于国际权威学术期刊《柳叶刀》(The Lancet)(IF=168.9),并由第一作者齐长松教授同步在2025年美国临床肿瘤学会(ASCO)进行大会口头报告,引起广泛关注。

6月3日,该研究结果也登上了Nature官网头条。
CT041-ST-01研究(NCT04581473)是全球首个针对实体瘤的CAR-T疗法随机对照临床试验,旨在评估Claudin18.2特异性CAR-T细胞治疗——Satricabtagene autoleucel (satri-cel)/舒瑞基奥仑赛注射液,相较于研究者选择治疗(TPC)在既往治疗失败的晚期胃癌或胃食管结合部癌(G/GEJC)患者中的疗效与安全性。
研究背景
CLDN18.2在多种消化道肿瘤中存在过表达,尤其对于G/GEJC,已成为该领域极具潜力的治疗靶点。舒瑞基奥仑赛(satri-cel)作为一种自体CLDN18.2特异性CAR-T细胞疗法,在既往治疗失败的晚期G/GEJC患者中开展的I期临床试验展现出令人鼓舞的疗效,沈琳教授团队已在2024年6月于《自然-医学》(Nature Medicine)发表了突破性结果(Qi, C. et al.Nat. Med. 2024. doi: 10.1038/s41591-024-03037-z),该研究为CAR-T疗法在实体瘤领域的深入探索提供了关键科学依据。基于上述研究结果,由沈琳教授团队设计主导了舒瑞基奥仑赛(satri-cel)在CLDN18.2表达阳性、至少二线治疗失败的晚期G/GEJC患者的确证性II期研究。
研究设计
本次II期研究是一项在中国开展的开放标签、多中心、随机对照试验,旨在对比舒瑞基奥仑赛与现有标准治疗在CLDN18.2表达阳性(定义为≥40%肿瘤细胞膜染色强度≥2+)、至少二线治疗失败晚期G/GEJC患者中的有效性和安全性。筛选合格的受试者以2:1的比例随机分配至satri-cel组(接受satri-cel输注250×106/次,最多3次输注),或研究者选择治疗(TPC)组(包括紫杉醇、多西他赛、伊立替康、纳武利尤单抗或阿帕替尼)。TPC组受试者如出现疾病进展或药物不耐受,根据研究者判断可接受后续的CT041治疗。主要终点为独立评审委员会(IRC)评价的无进展生存期(PFS),关键次要终点为总生存期(OS)。
研究结果
截至2024年10月18日,本研究共156例受试者随机入组,即意向性治疗(ITT)人群,包括satri-cel组104例、TPC组52例。两组分别有88例(84.6%)和48例(92.3%)受试者接受了试验药物,即调整的意向性治疗(mITT)人群。其中TPC组共20例受试者后续接受了CT041输注。所有受试者既往均接受过至少二线治疗,satri-cel组和TPC组分别有26.9% vs 19.2%受试者接受过至少三线治疗;腹膜转移比例69.2% vs 59.6%。
在ITT人群中:基于IRC评价,satri-cel较对照组可显著延长PFS(mPFS 3.25个月 vs 1.77个月;HR 0.37,95% CI: 0.24-0.56;p<0.0001),达到本试验的主要终点。同时OS显示出明显的获益趋势(mOS 7.92个月 vs 5.49个月;HR 0.69,95%CI: 0.46-1.05;单侧p=0.0416)。即便在satri-cel组15.4%(16例)未能接受细胞输注、TPC组近40%(20例)后续接受satri-cel输注的情况下,CT041组患者死亡风险下降仍超过30%。
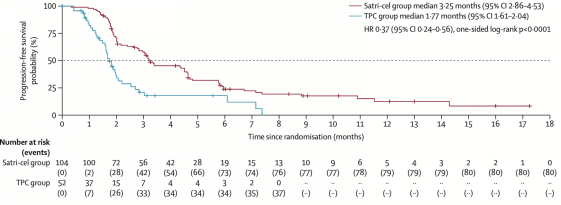
主要研究终点ITT人群PFS达阳性结果
在mITT即实际用药人群中:satri-cel组和TPC组基于IRC评价的mPFS为4.37个月 vs 1.84个月(HR 0.30,95%CI: 0.19-0.47);mOS为8.61个月 vs 5.49个月(HR 0.60,95%CI: 0.38-0.94)。因此在实际接受了细胞输注的患者中,CT041的治疗获益更加明显。
值得注意的是,TPC组20例接受satri-cel输注受试者的mOS达到9.20个月。satri-cel组和TPC组中所有接受satri-cel输注受试者(n=108)的mOS为9.17个月。
安全性方面,satri-cel组的整体耐受性良好,仅4例发生3级细胞因子释放综合症(CRS),无4-5级CRS。未发生免疫效应细胞相关神经毒性综合征(ICANS)事件。
研究结论
该研究是全球范围内实体瘤CAR-T领域首个开展的确证性随机对照试验,具有里程碑式意义。研究结果显示,在CLDN18.2表达阳性、至少二线治疗失败的G/GEJC患者中,舒瑞基奥仑赛(satri-cel)对比标准治疗可显著改善PFS,并展现出有临床意义的OS获益,同时具有可控的安全性特征。上述结果支持舒瑞基奥仑赛(satri-cel)成为晚期CLDN18.2阳性G/GEJC患者新的三线标准治疗方案。
齐长松教授在 ASCO 2025 大会口头报告现场接受媒体采访时也表示,“这些结果表明,CLDN18.2 CAR-T 疗法可能带来晚期胃癌治疗的范式转变,为实体瘤治疗领域带来几乎前所未有的细胞治疗新选择。”


VARELII(化名)是一位来自俄罗斯的急性B淋巴细胞白血病患者,二次移植后复发的消息,让他一度陷入了绝望的深渊,俄罗斯当地医院认为他几乎没有治愈的可能。

但VARELII没有放弃,通过多方了解和调研,他联系到了高博医疗集团北京高博博仁医院的赵德峰主任团队,在前期充分的沟通和全面的评估后,赵德峰主任团队接收了VARELII。“我以为我会被拒绝收治,但赵主任团队接受了我,并给予了我积极治疗的动力。”怀揣着最后一丝希望,在妻子的陪同下,VARELII不远万里,来到了北京高博博仁医院接受CAR-T治疗。
骨髓复发合并中枢复发
个性化CAR-T治疗后达到深度缓解
VARELII来到博仁医院后,先接受了全面的检查检验,经过检测发现不仅有骨髓复发,脑脊液中也有肿瘤细胞,实际是骨髓复发合并中枢复发的状态,病情十分危重。而且,在这次检查中还发现了BCR-ABL1的基因,这是在患者发病时未发现的,博仁医院通过精准基因检测,整合诊断,为患者的个性化治疗方案奠定了坚实的基础。

“患者来的时候非常虚弱,贫血、血小板低、肿瘤负荷高,再加上已经经历过两次移植,不论是身体还是心理,都承受着巨大的压力。”赵德峰主任团队首先跟患者进行了全方位的沟通,表示通过CAR-T细胞治疗的方式,疾病是有希望达到缓解的。先给予患者治疗的信心,再根据患者的状态制定个性化治疗方案。
赵德峰主任团队选择第一靶点采用供者来源的细胞,制备CD19 CAR-T细胞进行治疗,整体回输过程较为顺利,虽然还是出现了细胞因子释放综合征(CRS),有发热、皮疹的症状,但配合药物治疗,很快就有效地控制住了副反应。
“在俄罗斯二次复发后,我的心情是十分沉重的,通过这段时间的治疗以及和赵主任团队的沟通,我的信心慢慢恢复了,实际治疗效果也很好,感谢所有帮助过我的人,让一个原本已经失去希望的人,有了重新活下去的希望。”VARELII表示。
出院前,VARELII的骨穿结果显示他的骨髓已经达到了深度缓解,基因为0,腰穿结果显示脑脊液中的肿瘤细胞也已消散,白细胞、红细胞、血小板都基本恢复正常,疾病达到了一个非常好的完全缓解状态。

为了表示感谢,VARELII和妻子在出院前专门定制了锦旗,亲手送给了赵德峰主任团队,“整个治疗过程都让我非常感动,感谢博仁医院,感谢赵主任团队,让我能够重新开始工作和生活,希望下一次能带着家人来中国旅游,而不再是治病!”VARELII对未来的生活充满了期待。
专家点评
赵德峰主任:VARELII是Ph阳性B急淋患者,此前在俄罗斯两次移植后复发,属于复发难治病例。面对VARELII这样抱着最后希望不远万里来到中国求医的复发难治患者,我们团队首先做的是帮助患者建立信心,与患者及家人有一个全面的、充分的沟通,详细解释治疗方案,告诉患者他的疾病是有希望达到缓解的。
其次才是尽心尽力的治疗,通过精准诊断和个性化治疗方案,帮助患者获得更长的生存期。随着治疗过程中各项指标的好转,患者实实在在地感受到了我们团队的治疗疗效,患者的信心和彼此的信任都不断增加,使得整个治疗过程形成了良性循环。
针对VARELII的治疗,我们未来准备继续序贯第二个靶点的CAR-T,以及有针对性的连用靶向药,如果患者持续缓解时间能达到2-3年以上,还是有很大几率可以治愈的。非常开心VARELII达到完全缓解状态顺利出院,我们也会持续探索与进步,坚持“整合诊断”和“个性化治疗”的理念,不断提高复发难治血液肿瘤患者的治疗疗效,希望利用我们博仁医院先进的CAR-T细胞治疗技术,惠及更多的国内外患者。














